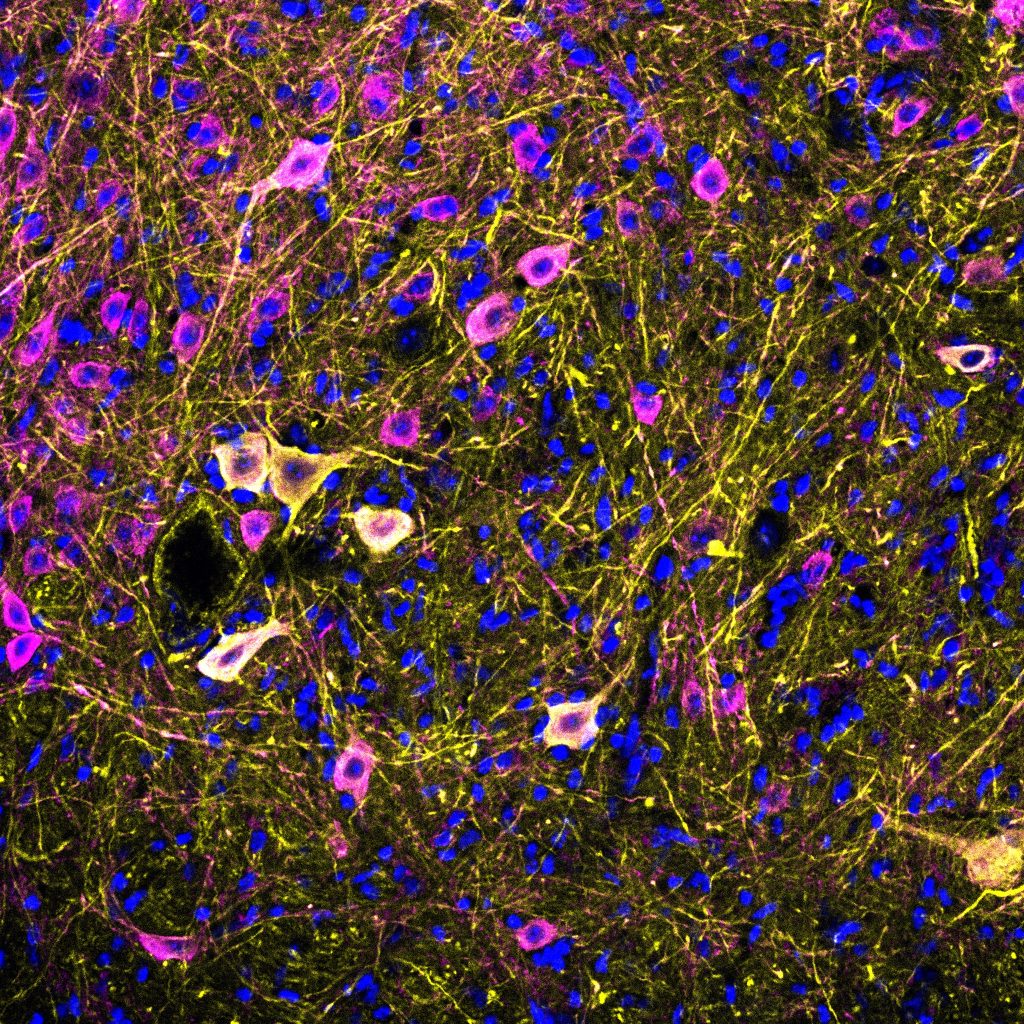
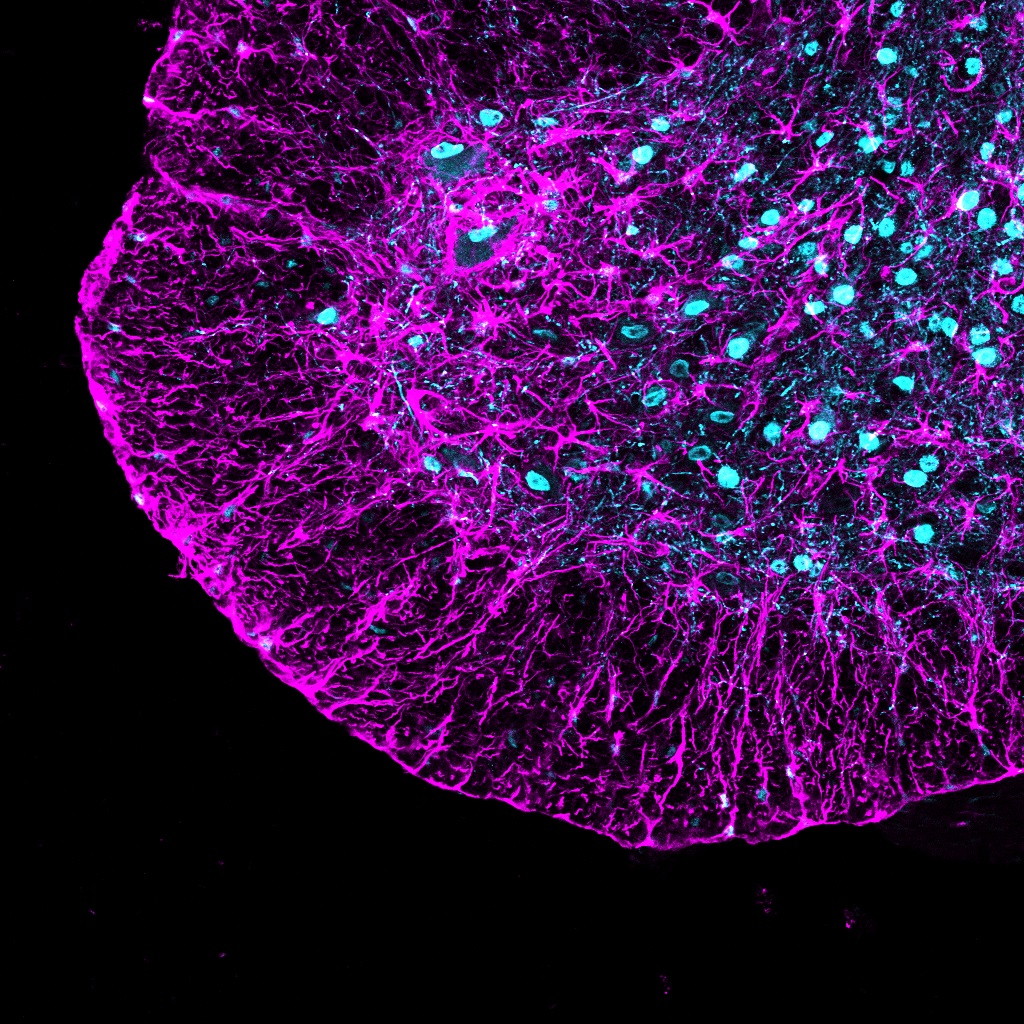
Dott. Mauro Cozzolino dell’Istituto di Farmacologia Traslazionale, Consiglio Nazionale delle Ricerche, Roma, e coordinatore studio: “I risultati raggiunti aggiungono un nuovo tassello alla comprensione dei meccanismi alla base della SLA”
Milano, 04/04/2025 – Si chiama ‘splicing’ il processo chiave che consente alle molecole di RNA di ottenere diverse proteine, a partire dallo stesso gene, e permettere un corretto funzionamento delle nostre cellule. Questo importante processo risulta alterato nelle forme familiari di SLA associate alle mutazioni del gene FUS.
Ad aggiungere un nuovo tassello sulla comprensione di questo processo e il suo ruolo nello sviluppo della SLA sono i risultati dello studio preclinico da poco pubblicato sulla rivista ‘Cell Death and Disease’, coordinato dal Dott. Mauro Cozzolino dell’Istituto di Farmacologia Traslazionale, Consiglio Nazionale delle Ricerche, Roma, che ha mostrato il legame tra il gene FUS e un altro gene A2/B1, un gene fondamentale per il metabolismo dell’RNA. In particolare, ha evidenziato come lo ‘splicing’ del gene A2/B1 si modifichi nel corso della malattia in modelli di SLA in cui il gene FUS è alterato e che le varianti derivate da questo errato ‘splicing’ di A2/B1 si accumulano in modo errato nella cellula, formando granuli di stress, strutture tipiche delle malattie neurodegenerative come la SLA, e quindi identificati come potenziali bersagli terapeutici.
La ricerca è stata finanziata da Fondazione AriSLA, principale ente non profit in Italia che sostiene ricerca scientifica sulla SLA, grazie all’annuale Bando con cui seleziona le idee più innovative e valide per identificare soluzioni terapeutiche efficaci. Il progetto AriSLA ‘SWITCHALS’ ha come partner Nadia D’Ambrosi del Dipartimento di Biologia dell’Università degli Studi di Roma Tor Vergata.
In questo progetto abbiamo analizzato come lo splicing di A2/B1 cambi nel corso della malattia in modelli in cui il gene FUS è alterato. I nostri risultati mostrano che, con il progredire della malattia, nei neuroni motori del midollo spinale si accumulano varianti di A2/B1 prive di una breve porzione proteica. Questo piccolo cambiamento – sottolinea il Dott. Cozzolino – ha tuttavia conseguenze importanti, perché queste varianti si accumulano nel citoplasma, anziché rimanere nel nucleo come avviene normalmente, indicando che il loro errato posizionamento all’interno della cellula possa essere un elemento chiave nel processo patologico.
Questo fenomeno è molto simile a quanto già dimostrato per altre proteine che hanno un ruolo nella regolazione dell’RNA, tra cui TDP43, che nella malattia vanno incontro ad un riposizionamento dal nucleo al citoplasma. Un altro aspetto fondamentale è che le varianti di A2/B1 che si accumulano nel citoplasma tendono a formare granuli di stress, strutture associate a condizioni di stress cellulare tipiche delle malattie neurodegenerative, inclusa la SLA”.
Le prospettive di ricerca
Lo studio ha dimostrato inoltre come lo splicing scorretto di A2/B1 indotto attraverso molecole di RNA modificate, chiamate oligonucleotidi antisenso (ASO), comporti la comparsa di alterazioni in modelli di studio legati al gene FUS.
“Questo risultato – conclude il Dott. Cozzolino – apre la strada a nuovi esperimenti, alcuni già in corso, per lo sviluppo di oligonucleotidi antisenso in grado di correggere lo specifico difetto nello splicing alternativo che abbiamo individuato ed eventualmente contrastare, in modelli preclinici di SLA, la degenerazione dei motoneuroni e quindi l’insorgenza e la progressione della malattia”.